Задачи на практический выход. Задачи на практический выход Чему равен выход
В химии теоретический выход – это максимальное количество продукта, которое получается в результате химической реакции. На самом деле большинство реакций не являются идеальными, то есть практический выход продукта всегда меньше теоретического. Чтобы вычислить эффективность реакции, необходимо найти процент выхода продукта по формуле: выход (%) = (практический выход/теоретический выход) x100. Если процент выхода равен 90%, это означает, что реакция эффективна на 90%, а 10% реагентов были потрачены впустую (они не вступили в реакцию или не соединились).
Шаги
Часть 1
Найдите ключевой компонент реакции- Вы взяли 1,25 моль кислорода и 0,139 моль глюкозы. Молярное соотношение кислорода и глюкозы: 1,25/0,139 = 9. Это означает, что на 1 молекулу глюкозы приходятся 9 молекул кислорода.
-
Найдите оптимальное соотношение реагентов. Вернитесь к сбалансированному уравнению, которое вы записали ранее. С помощью этого уравнения можно определить оптимальное соотношение реагентов, то есть соотношение, при котором оба вещества будут израсходованы одновременно.
Сравните соотношения, чтобы найти ключевой компонент реакции. В химической реакции один реагент расходуется быстрее другого. Такой ключевой реагент определяет скорость химической реакции. Сравните два соотношения, которые вы вычислили, чтобы найти ключевой реагент:
- Если молярное соотношение больше оптимального, вещества, которое находится в числителе дроби, слишком много. При этом вещество, которое находится в знаменателе дроби, является ключевым реагентом.
- Если молярное соотношение меньше оптимального, вещества, которое находится в числителе дроби, слишком мало и оно является ключевым реагентом.
- В нашем примере молярное соотношение (кислород/глюкоза = 9) больше оптимального соотношения (кислород/глюкоза = 6). Таким образом, вещество, которое находится в знаменателе дроби (глюкоза), является ключевым реагентом.
Часть 2
Вычислите теоретический выход продукта-
Определите продукты реакции. В правой части химического уравнения перечислены продукты реакции. Каждый продукт имеет теоретический выход, то есть количество продукта, которое получится в случае идеальной реакции.
Запишите число молей ключевого реагента. Теоретический выход продукта равен количеству продукта, который получится при идеальных условиях. Чтобы вычислить теоретический выход, начните с числа молей ключевого реагента (читайте предыдущий раздел).
- В нашем примере вы выяснили, что ключевым реагентом является глюкоза. Также вы вычислили, что взяли 0,139 моль глюкозы.
-
Найдите соотношение молекул продукта и реагента. Вернитесь к сбалансированному уравнению. Разделите количество молекул продукта на количество молекул ключевого реагента.
-
Умножьте полученное соотношение на количество реагента в молях. Так вы получите теоретический выход продукта (в молях).
- Вы взяли 0,139 моль глюкозы, а отношение углекислого газа к глюкозе равно 6. Теоретический выход углекислого газа: (0,139 моль глюкозы) x (6 моль углекислого газа/1 моль глюкозы) = 0,834 моль углекислого газа.
-
Полученный результат преобразуйте в граммы. Полученное число молей умножьте на молярную массу продукта, чтобы найти теоретический выход в граммах. Эту единицу измерения можно использовать в большинстве экспериментов.
- Например, молярная масса CO 2 приблизительно равна 44 г/моль (молярная масса углерода ≈ 12 г/моль, молярная масса кислорода ≈ 16 г/моль, поэтому 12 + 16 + 16 = 44).
- Перемножьте: 0,834 моль CO 2 x 44 г/моль CO 2 ≈ 36,7 г. Теоретический выход продукта равен 36,7 г CO 2 .
Найдите молярную массу каждого исходного вещества. Определите молярную массу каждого атома вещества, а затем сложите молярные массы, чтобы вычислить молярную массу всего вещества. Сделайте это для одной молекулы реагента.
Преобразуйте массу каждого реагента из граммов в число молей. Теперь рассмотрите реакцию, которую вы собираетесь провести. Запишите массу каждого реагента в граммах. Полученное значение разделите на молярную массу вещества, чтобы преобразовать граммы в число молей.
Найдите молярное соотношение реагентов. Помните, что моль – это величина, которая используется химиками для «подсчета» молекул. Вы определили количество молекул каждого исходного вещества. Разделите число молей одного реагента на число молей другого, чтобы найти молярное соотношение двух реагентов.
Задачи на практический выход.
1 .Вычислите объем аммиака, который можно получить, нагревая 20г хлорида аммония с избытком гидроксида кальция, если объемная доля выхода аммиака составляет 98%.
2NH 4 Cl + Ca(OH) 2 = 2NH 3 +H 2 O; Mr(NH 4 Cl) =53,5
NH 4 Cl +0,5Са(ОH ) 2 = NH 3 +0,5H 2 O
1)Рассчитаем теоретический выход
20/53,5=Х/22,4; Х=8,37л(это теоретический выход)
2) Рассчитаем практический выход
V (практического)=V (теоретического)/выход прдукта*100%
V (практического)=8,37л*98%/(делим на) 100% = 8.2л
Ответ: 8,2 л N Нз
2.Из 320г сернистого колчедана, содержащего 45% серы, было получено 405г серной кислоты (расчёт на безводную кислоту). Вычислите массовую долю выхода серной кислоты.
Составим схему производственного получения серной кислоты
320г 45% 405г, ή-?
FeS 2 → S → H 2 SO 4
1)Рассчитаем долю серы в колчедане
2)Рассчитаем теоретический выход серной кислоты

3) Рассчитаем выход продукта в процентах
З.Вычислите массу фосфора необходимую для получения 200 кг фосфорной кислоты, если массовая доля выхода продукта составляет 90%.
Составим схему производственного получения фосфорной кислоты
Х 200кг,ή=90%
P → H 3 PO 4
1)Рассчитаем массу теоретического выхода фосфорной кислоты
m
т =


2) Рассчитаем массу фосфора
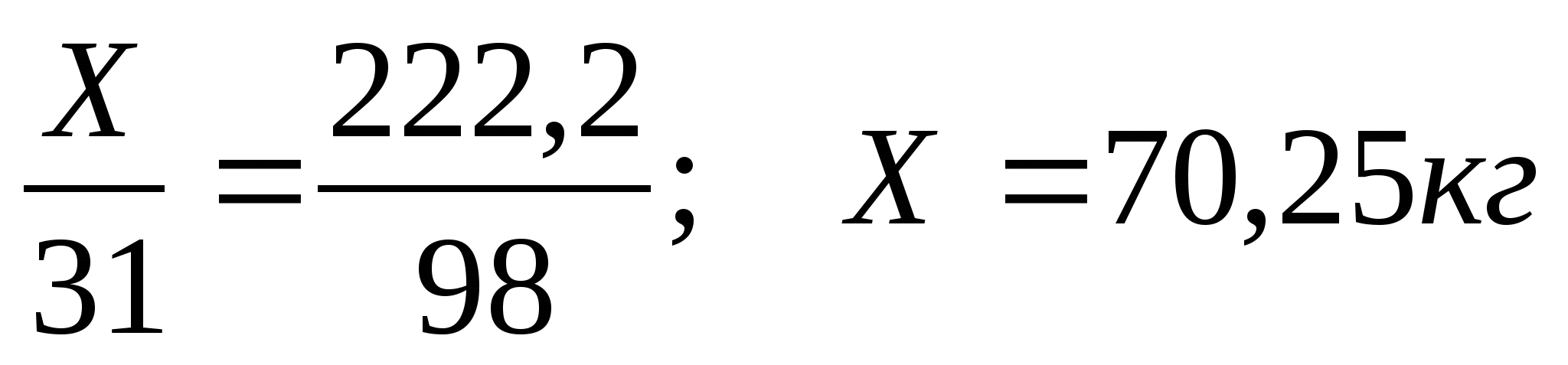
Ответ:70,Зкг
4.Юный химик на занятиях кружка решил получить азотную кислоту реакцией обмена между нитратом калия и концентрированной серной кислотой. Вычислить массу азотной кислоты, которую он получил из 20,2г- нитрата калия, если массовая доля выхода кислоты была 0,98
5.При нагревании нитрита аммония N Н 4 NO 2 образуются азот и вода. Вычислите объем азота (н. у), который можно получить при разложении 6,4г нитрита аммония, если объемная доля выхода азота составляет 89%.
6.Вычислите объем оксида азота (II), который можно получит при каталитическом окислении в лаборатории 5,6л аммиака, если объемная доля выхода оксида азота (II ) равна 90%.
7.Металлический барий получают восстановлением его оксида металлическим алюминием c образованием оксида алюминия и бария. Вычислите массовую долю выхода бария, если из 4,59 кг оксида бария было получено 3,8 кг бария.
Ответ: 92,5%
8.Определите, какая масса меди потребуется для реакции с избытком концентрированной азотной кислоты для получения 2,1 л (н. у) оксида азота (IV ), если объемная доля выхода оксида азота (IV ) равна 94%.
Ответ: 3,19
9.Какой объем оксида серы (IV ) надо взять для реакции окисления кислородом, чтобы получить оксид серы (V I) массой 20г. если выход продукт равен 80% (н.у).?
2SO
2
+ O
2
= 2SO
3
; V.(SO
2
)
=22.4
л; Mr(SO
3
) =80
1) Рассчитаем теоретический выход
m
(теорет) = 
2)Рассчитаем массу SO 2

10.При нагревании смеси оксида кальция массой 19,6г с коксом массой 20г получили карбид кальция массой 16г. Определите выход карбида кальция, если массовая доля углерода в коксе составляет 90%.
Ответ: 71.4%
11 .Через раствор массой 50г с массовой долей иодида натрия 15% пропустили избыток хлора, выделился йод массой 5,6г. Определите выход продукта реакции от теоретически возможного в %.
Ответ: 88,2%.
12.Определить выход силиката натрия в % к теоретическому, если при сплавлении 10 кг гидроксида натрия с оксидом кремния (IV ) получено 12,2 кг силиката натрия. Ответ 80%
13.Из 4 кг оксида алюминия удаётся выплавить 2 кг алюминия. Вычислите массовую долю выхода алюминия от теоретически возможного.
Ответ:94,3%
14.Вьичислите объем аммиака, который получается при нагревании смеси хлорида аммония массой 160,5 г и гидроксида кальция, если объемная доля выхода аммиака от теоретически возможного составляет 78%.
Ответ:52.4л
15.Какое количество аммиака потребуется для получения 8 т нитрата аммония, если выход продукта составляет 80% от теоретически возможного?
Ответ:2,IЗт
16.Какое количество уксусного альдегида может быть получено по реакции Кучерова, если в реакцию вступило 83,6 л ацетилена, а практический выход составил 80% от теоретически возможного?
Ответ: 131,З6г
17.Какое количество бензола потребуется для получения 738г нитробензола, если практический выход составляет 92% от теоретического.?
Ответ 508.75г
1 8.При нитрировании 46,8 бензола получено 66,42г нитробензола. Определите практический выход нитробензола в % от теоретически возможного.
19.Сколько граммов бензола можно получить из 22,4 л ацетилена, если практический выход бензола составил 40%.?
20.Какой объем бензола (ρ=0,9г/см 3) потребуется, чтобы получить 30,75г нитробензола, если выход при нитровании составляет 90% от теоретически возможного?
21 .Из 32г этилена было получено 44г спирта. Вычислите практический выход продукта в % от теоретически возможного.
22.Сколько граммов этилового спирта можно получить из 1м 3 природного газа, содержащего 6% этилена, если практический выход составил 80%?
23.Какое количество кислоты и спирта необходимо для получения 29,6г уксуснометилового эфира, если его выход составил 80% от теоретически возможного?
24.При гидролизе 500кг древесины, содержащей 50% целлюлозьг, получается 70кг глюкозы. Вычислите ее практический выход в % от теоретически возможного.
25.Сколько глюкозы получается из 250 кг опилок, содержащих 40% глюкозы. Какое количество спирта можно получить из этого количества глюкозы при 85%-ном практическом выходе?
Ответ:43,43г
26.Сколько граммов нитробензола нужно взять, чтобы восстановлением получить 186г анилина, выход которого составляет 92% от теоретического 27. Вычислите массу сложного эфира, который получили из 460г муравьиной кислоты и 460г этилового спирта. Выход эфира от теоретически возможного составляет 80%.
28.При обработке 1т фосфорита, содержащего 62% фосфата кальция, серной кислотой было получено 910,8кг суперфосфата. Определить выход суперфосфата в % по отношению к теоретическому.
Са 3 (РО 4) 2 + 2Н 2 S 0 4 = Са (Н 2 Р0 4) 2 + 2СаS 0 4
З0.Для получения кальциевой селитры, 1т мела обработали разбавленной азотной кислотой. При этом выход кальциевой селитры составил 85% по отношению к теоретическому. Сколько селитры было получено?
Ответ: 1394кг
31 .Из 56кг азота было синтезировано 48 кг аммиака. Каков выход аммиака в процентах к теоретическому.
Ответ: 70,5%
32. 34 кг аммиака пропустили через раствор серной кислоты. Выход сульфата аммония составил 90% от теоретического. Сколько килограммов сульфата аммония получено?
Ответ:118,8кг
З3.При окислении З4кг аммиака было получено 54кг окиси азота (II ).Вычислить выход окиси азота в % по отношению к теоретическому.
34.В лаборатории аммиак получают взаимодействием хлористого аммония с гашёной известью. Сколько граммов аммиака было получено, если израсходовано 107г хлористого аммония и выход аммиака составил 90% от теоретического?
Ответ:30,6г
35.Из 60кг водорода и соответствующего количества азота было синтезировано 272 кг аммиака. Каков выход аммиака в % к теоретически возможному?
36. Из 86,7г натриевой селитры, содержащей 2% примесей, получено 56,7г азотной кислоты, каков выход азотной кислоты в % к теоретически возможному?
Ответ: 90%.
37.При пропускания аммиака через 6Зкг 50% раствора азотной кислоты было получено З8кг аммиачной селитры. Каков выход ее в % к теоретически возможному?
38.Для получения фосфорной кислоты было израсходовано ЗI4кг фосфорита, содержащего 50% фосфата кальция. Выход фосфорной кислоты составил 95%.Сколько кислоты было получено?
Ответ:94,Зкг
39. 49кг 50% раствора серной кислоты было нейтрализовано гашёной известью, причем получилось 30,6кг сульфата кальция. Определить выход продукта в % к теоретическому.
40.Фосфор получают в технике по уравнению реакции;
Саз (Р0 4) 2 + 3SiО 2 +5С →ЗСaSi О 3 + 2Р +5СО
Каков выход фосфора в % к теоретическому, если его получилось 12,4 кг из 77 кг фосфорнокислого кальция?
Ответ: 80,5%
41 .Вычислите выход карбида кальция в % к теоретическому, если 15,2кг его
были получены из I4кг окиси кальция.
42. Ацетилен получают взаимодействием.карбида кальция с водой
СаС 2 +2Н 2 0= Са(ОН) 2 +С 2 Н 2
Сколько граммов ацетилена получится, если израсходовано 33,7г карбида кальция, содержащего 5% примесей и выход ацетилена составил 90% к теоретическому?
Ответ: 11,7г
43.При действии соляной кислоты на 50г мела получилось 20г углекислого газа. Каков выход его в % к теоретическому?
Ответ: 90,9%
44.При обжиге 1т известняка, содержащего 10% примесей, выход углекислого газа составил 95%. Сколько килограммов углекислого газа было получен?
Ответ: 376,2 кг.
45. Определить выход силиката натрия в % к теоретическому, если при сплавлении 10кг едкого натра с песком получено 12,2 кг силиката натрия.
Работа выхода
энергия, затрачиваемая на удаление электрона из твёрдого тела или жидкости в вакуум. Переход электрона из вакуума в конденсированную среду сопровождается выделением энергии, равной Р. в. Следовательно, Р. в. является мерой связи электрона с конденсированной средой; чем меньше Р. в., тем легче происходит эмиссия электронов. Поэтому, например, плотность тока термоэлектронной эмиссии (См. Термоэлектронная эмиссия) или автоэлектронной эмиссии (см. Туннельная эмиссия) экспоненциально зависит от Р. в. Р. в. наиболее полно изучена для проводников, особенно для металлов (См. Металлы). Она зависит от кристаллографической структуры поверхности. Чем плотнее «упакована» грань кристалла, тем выше Р. в. φ. Например, для чистого вольфрама φ = 4,3 эв
для граней {116} и 5,35 эв
для граней {110}. Для металлов возрастание (усреднённых по граням) φ приблизительно соответствует возрастанию потенциала ионизации. Наименьшие Р. в. (2 эв
) свойственны щелочным металлам (Cs, Rb, К), а наибольшие (5,5 эв
) -
металлам группы Pt. Р. в. чувствительна к дефектам структуры поверхности. Наличие на плотноупакованной грани собственных неупорядоченно расположенных атомов уменьшает φ. Ещё более резко φ зависит от поверхностных примесей: электроотрицательные примеси (кислород, галогены, металлы с φ,
большей, чем φ подложки) обычно повышают φ, а электроположительные - понижают. Для большинства электроположительных примесей (Cs на W, Tn на W, Ba на W) наблюдается снижение Р. в., которая достигает при некоторой оптимальной концентрации примесей n
oпт минимального значения, более низкого, чем φ основного металла; при n
≈ 2n
oпт Р.
в. становится близкой к φ металла покрытия и далее не изменяется (см. рис.
). Величине n
oпт соответствует упорядоченный, согласованный со структурой подложки слой атомов примеси, как правило, с заполнением всех вакантных мест; а величине 2n
oпт - плотный моноатомный слой (согласование со структурой подложки нарушено). Т. о., Р. в. по крайней мере для материалов с металлической электропроводностью определяется свойствами их поверхности. Электронная теория металлов рассматривает Р. в. как работу, необходимую для удаления электрона с Ферми уровня в вакуум. Современная теория не позволяет пока точно вычислить φ для заданных структур и поверхностей. Основные сведения о значениях φ даёт эксперимент. Для определения φ используют эмиссионные или контактные явления (см. Контактная разность потенциалов).
Знание Р. в. существенно при конструировании электровакуумных приборов (См. Электровакуумные приборы), где используется эмиссия электронов или ионов, а также в таких, например, устройствах, как термоэлектронные преобразователи (См. Термоэлектронный преобразователь) энергии. Лит.:
Добрецов Л. Н., Гомоюнова М. В., Эмиссионная электроника, М., 1966; Зандберг Э. Я., Ионов Н. И., Поверхностная ионизация, М., 1969. В. Н. Шредник.
Большая советская энциклопедия. - М.: Советская энциклопедия . 1969-1978 .
Смотреть что такое "Работа выхода" в других словарях:
Разница между минимальной энергией (обычно измеряемой в электрон вольтах), которую необходимо сообщить электрону для его «непосредственного» удаления из объёма твёрдого тела, и энергией Ферми. Здесь «непосредственность» означает то, что электрон… … Википедия
Энергия Ф, к рую необходимо затратить для удаления эл на из твёрдого или жидкого в ва в вакуум (в состояние с равной нулю кинетич, энергией). Р. в. Ф=еj, где j потенциал Р. в., е абс. величина электрич. заряда электрона. Р. в. равна разности… … Физическая энциклопедия
работа выхода - электрона; работа выхода Работа, соответствующая разности энергий между уровнем химического потенциала в теле и уровнем потенциала вблизи поверхности тела вне его при отсутствии электрического поля … Политехнический терминологический толковый словарь
Работа, которую необходимо затратить для удаления электрона из конденсированного вещества в вакуум. Измеряется разностью между минимальной энергией электрона в вакууме и Ферми энергией электронов внутри тела. Зависит от состояния поверхности… … Большой Энциклопедический словарь
РАБОТА ВЫХОДА, энергия, затрачиваемая на удаление электрона из вещества. Учитывается при ФОТОЭЛЕКТРИЧЕСКОМ ЭФФЕКТЕ и в ТЕРМОЭЛЕКТРОНИКЕ … Научно-технический энциклопедический словарь
работа выхода - Энергия, необходимая для переноса в бесконечность электрона, находящегося в исходном положении на уровне Ферми в данном материале. [ГОСТ 13820 77] Тематики электровакуумные приборы … Справочник технического переводчика
работа выхода - энергия, затрачиваемая на удаление электрона из твердого тела или жидкости в вакуум. Переход электрона из вакуума в конденсированную среду сопровождается выделением энергии, равной работе выхода; чем меньше работа выхода, тем… … Энциклопедический словарь по металлургии
работа выхода - Work Function Работа выхода Минимальная энергия (обычно измеряемая в электрон вольтах), которую необходимо затратить для удаления электрона из объема твёрдого тела. Электрон удаляется из твердого тела через данную поверхность и перемещается в … Толковый англо-русский словарь по нанотехнологии. - М.
Работа, которую необходимо затратить для удаления электрона из конденсированного вещества в вакуум. Измеряется разностью между минимальной энергией электрона в вакууме и ферми энергией электронов внутри тела. Зависит от состояния поверхности… … Энциклопедический словарь
работа выхода - išlaisvinimo darbas statusas T sritis Standartizacija ir metrologija apibrėžtis Darbas, kurį atlieka 1 molis dalelių (atomų, molekulių, elektronų) pereidamas iš vienos fazės į kitą arba į vakuumą. atitikmenys: angl. work function vok.… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
работа выхода - išlaisvinimo darbas statusas T sritis fizika atitikmenys: angl. work function; work of emission; work of exit vok. Ablösearbeit, f; Auslösearbeit, f; Austrittsarbeit, f rus. работа выхода, f pranc. travail de sortie, m … Fizikos terminų žodynas
Формула работа выхода электронов
В металлах имеются электроны проводимости, образующие электронный газ и участвующие в тепловом движении. Так как электроны проводимости удерживаются внутри металла, то, следовательно, вблизи поверхности существуют силы, действующие на электроны и направленные внутрь металла. Чтобы электрон мог выйти из металла за его пределы, должна быть совершена определенная работа А против этих сил, которая получила название работа выхода электрона из металла. Эта работа, естественно, различна для разных металлов.
Потенциальная энергия электрона внутри металла постоянна и равна:
W p = -eφ , где j – потенциал электрического поля внутри металла.
При переходе электрона через поверхностный электронный слой потенциальная энергия быстро уменьшается на величину работы выхода и становится вне металла равной нулю. Распределение энергии электрона внутри металла можно представить в виде потенциальной ямы.
В рассмотренной выше трактовке работа выхода электрона равна глубине потенциальной ямы, т.е.
A вых = eφ
Этот результат соответствует классической электронной теории металлов, в которой предполагается, что скорость электронов в металле подчиняется закону распределения Максвелла и при температуре абсолютного нуля равна нулю. Однако в действительности электроны проводимости подчиняются квантовой статистике Ферми-Дирака, согласно которой при абсолютном нуле скорость электронов и соответственно их энергия отлична от нуля.
Максимальное значение энергии, которой обладают электроны при абсолютном нуле, называется энергией Ферми E F . Квантовая теория проводимости металлов, основанная на этой статистике, дает иную трактовку работы выхода. Работа выхода электрона из металла равна разности высоты потенциального барьера eφ и энергии Ферми.
A вых = eφ" - E F
где φ" – среднее значение потенциала электрического поля внутри металла.
Таблица работа выхода электронов из простых веществ
|
Вещество |
Формула вещества |
Работа выхода электронов (W, эВ) |
|
алюминий |
||
|
бериллий |
||
|
углерод (графит) |
||
|
германий |
||
|
марганец |
||
|
молибден |
||
|
палладий |
||
|
празеодим |
||
|
олово (γ-форма) |
||
|
олово (β-форма) |
||
|
стронций |
||
|
вольфрам |
||
|
цирконий |
Таблица работа выхода электронов из неорганических соединений
В таблице приведены значения работы выхода электронов, относящихся к поликристаллическим образцам, поверхность которых очищена в вакууме прокаливанием или механической обработкой. Недостаточно надежные данные заключены в скобки.
|
Вещество |
Формула вещества |
Работа выхода электронов (W, эВ) |
|
бромистое серебро |
||
|
хлористое серебро |
||
|
иодистое серебро |
||
|
сульфид серебра |
||
|
триоксид бора |
||
|
оксид бария |
||
|
барий вольфрамовокислый |
||
|
окись бериллия |
||
|
окись кальция |
||
|
ортовольфрамат кальция |
||
|
борид хрома |
||
|
окись цезия |
||
|
окись меди |
||
|
закись меди |
||
|
окись железа |
||
|
карбид гафния |
||
|
оксид магния |
||
|
диборид марганца |
||
|
диборид молибдена |
||
|
триоксид молибдена |
||
|
силицид молибдена |
||
|
хлористый натрий |
||
|
борид ниобия |
||
|
карбид ниобия |
||
|
окись никеля |
||
|
борид скандия |
||
|
кремнезём |
||
|
окись стронция |
||
|
карбид тантала |
||
|
пентаоксид тантала |
||
|
дикарбид тория |
||
|
оксид тория |
||
|
сульфид титана |
||
|
диборид титана |
||
|
карбид титана |
||
|
нитрид титана |
||
|
окись титана |
||
|
двуокись титана |
||
|
карбид урана |
||
|
диборид ванадия |
||



